Принцип работы
Молекула дезоксирибонуклеиновой кислоты (собственно ДНК) состоит из двух связанных между собой цепочек из нуклеотидных звеньев.

При этом «голова» одной цепочки связана с «хвостом» другой. Водородные связи образуются между строго определенными азотистыми основаниями. В них различные для разных нуклеотидов части. Так, например, гуанин из одной цепочки может связываться только с цитозином другой и т.д. Вот почему, если в наличии имеется одна цепочка ДНК, то следуя правилам взаимодействия можно воспроизвести вторую цепочку. Такая особенность построения ДНК и стала сутью обсуждаемого метода.
Для реализации исследования требуются:
- анализируемая ДНК или ее кусочек, который станет матрицей для копирования своей части
- праймеры – созданные синтетически в лаборатории небольшие нуклеотидные последовательности, которые соответствуют по принципу взаимодействия нужным зонам анализируемой ДНК
- нуклеотиды – «строительный материал»
- ДНК-полимераза – выделенный из бактерий или архей (своеобразных одноклеточных безъядерных организмов) фермент, который запускает реакцию синтеза от одного конца праймера
- буфер – раствор, который обеспечивает поддержание необходимой для работы фермента кислотности среды, а также содержит вещества, препятствующие прилипанию реагентов к стенкам реакционного сосуда и предотвращающие нежелательные побочные взаимодействия.
Все смешивают в дистиллированной воде и помещают в амплификатор. Это специальное устройство, в котором реализуется периодические нагрев/охлаждение реакционной смеси с высокой точностью и за считанные секунды.

Обычно требуется синтез кусочков ДНК из 2000-3000 нуклеотидных пар, что достигается за два-три десятка трехэтапных циклов.
Циклы:
- Денатурация – разрушение водородных связей путем нагрева и разъединение в результате двух цепочек ДНК.
- Отжиг праймеров – присоединение праймеров к освободившимся молекулам ДНК с разных сторон кусочка, который требуется скопировать. Реакция проводится при строго заданной температуре, чтобы данные праймеры взаимодействовали только с нужными зонами. Разработку праймеров проводят с предварительным расчетом с помощью компьютерных программ с учетом всех требований.
- Синтез ДНК – собственно построение ДНК-цепи полимеразой из нуклеотидных «кирпичиков». Сначала фермент «крепится» к комплексу матрица-праймер, а затем подбирает необходимый нуклеотид из раствора согласно принципу взаимодействия. Скорость реакции ‑ примерно 3000 нуклеотидов в минуту. Полученная новая молекула служит еще одной матрицей и проходит вместе с «родительской» весь цикл. В результате, количество продукта увеличивается все быстрее и быстрее.
После завершения синтеза на специальном геле с окрашиванием проводят элетрофорез реакционной смеси. Цель – пространственное разделение молекул ДНК, которые становятся заметны визуально (или под УФ-светом). Данный метод позволяет установить, есть ли определенная последовательность нуклеотидных звеньев в исследуемой ДНК. Называется «качественный метод ПЦР».
Другие разновидности ПЦР
Если в роли матрицы исследуемой выступает РНК (например, при изучении РНК вирусов), используется ПЦР с обратной транскрипцией (RT PCR, который важно отличать от такой разновидности, как метод real-time PCR). В данном варианте используется обратная транскриптаза. Это фермент, который по имеющейся РНК выстраивает соответствующую ей ДНК, после чего проводится обычная ПЦР. Для установления в исследуемом материале числа молекул ДНК применяется количественная ПЦР.

Которая и называется real-time PCR, ПЦР «в реальном времени». В этой технике также возможно использование РНК.
В чем заключается главное отличие качественного и количественного методов ПЦР? В последнем случае после каждого цикла проводится замер количества воспроизведенной молекулы флюоресцентными методами. В практической медицине то, какой метод ПЦР качественный или количественный для анализа на инфекции необходим, определяет врач. На основании предполагаемого диагноза и цели исследования (например, для контроля эффективности лечения). В таком режиме часто проводится ПЦР на гепатит С или В. Причем при качественном определении расшифровка результатов не представляет сложности для неспециалиста. Положительный результат - «обнаружено», т.е. выявлен фрагмент ДНК вируса, отрицательный – «не обнаружено». Расшифровать количественный анализ ПЦР на гепатит С можно, воспользовавшись референсными значениями лаборатории, проводившей исследование. Результат «не обнаружено» указывается, если вирусная ДНК вообще не выявлена. Или ее количество меньше предела чувствительности (15-20 МЕ/мл).
- «Меньше 10 во 2-й степени МЕ/мл» –положительный результат с соответствующим содержанием вируса.
- «От 10 во 2-й степени до 10 в 8-й степени МЕ/мл» – положительный результат с содержанием вирусных частиц в указанных пределах.
- «Более 10 в 8-й степени» ‑ концентрация превышает указанное число.
Результат выше верхнего предела измеряемого диапазона, не определяется с достаточной точностью. Различные варианты ПЦР могут использоваться для исследования не ДНК/РНК, а гормонов, токсинов, антител и иных молекул. Принцип такой иммуно-ПЦР ‑ присоединение к выявляемым молекулам (антигенам) ДНК-меченных антител. С последующим копированием ДНК-частей и определением типа и количества анализируемых молекул. Метод позволяет обнаружить инфекционные антигены на самых ранних стадиях болезни.

Способы осуществления ПЦР
На сегодняшний день существует несколько десятков методик для реализации ПЦР:
- с горячим стартом – в реакционную среду вносят полимеразу в комплексном соединении с антителами, ингибирующими ее деятельность (поэтому фермент «высвобождается» только в заданный момент реакции);
- ступенчатая – первые несколько циклов реализуют при более высоких температурах праймерного отжига для увеличения специфичности связывания последних с матричной ДНК, а после накопления некоторого количества новых ДНК-молекул температуру снижают до оптимальной;
- мультиплексная – для выявления сразу нескольких последовательностей используют набор различных праймеров
- метод RAPD (Random Amplification of Polymorphic DNA – анализ ПЦР случайных полиморфных фрагментов ДНК) – позволяет различить сходные по структуре молекулы, например, дифференцировать виды бактерий, за счет использования очень небольшого праймера (не более 10 нуклеотидов)
- асимметричная – применяют при необходимости скопировать только одну цепочку анализируемой ДНК, для чего один из праймеров берется в заметном избытке
- вложенная – используют для снижения количества побочных продуктов за счет добавления двух праймерных наборов и проведения двух реакций последовательно (сначала с праймером для копирования длинного фрагмента, затем – короткого)
-
инвертированная – к методу прибегают, когда последовательность некоторого участка цепи известна, но копирование требуется для другого участка, для чего проводят
- «разрезание» ДНК рестриктазой
- «закольцовывание» фрагмента лигазой, так что известные участки оказываются на концах неизвестного
- проведение стандартной ПЦР
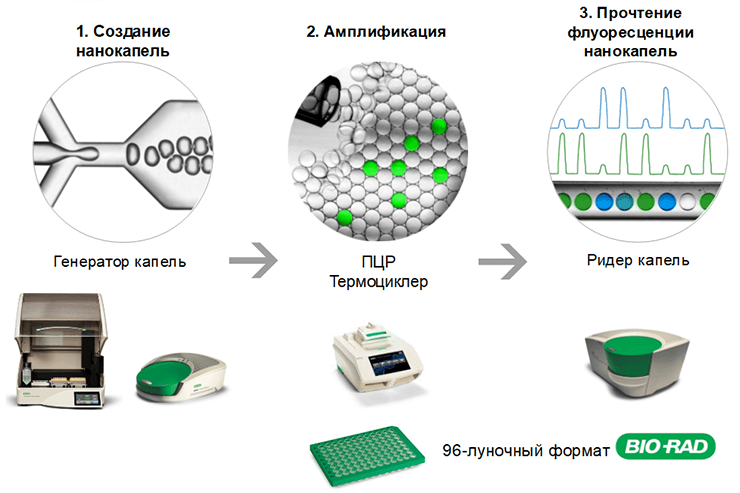
- цифровая капельная – более точная, чем вариант «в реальном времени», основана на разделении пробы на множество маленьких капель и реализации полимеризации в каждой из них
- виртуальная – представляет собой аналитический подход для теоретической ПЦР, позволяет оптимизировать подбор праймеров, предсказывать результат копирования и т.д.
- многое другое.
Таким образом, на сегодняшний день метод является самым мощным вариантом лабораторного исследования.
Его неоспоримые плюсы:
- высочайшая точность и специфичность
- совместимость с иными техниками
- высокая пластичность – возможность решать самые разнообразные задачи
- постоянное совершенствование, появление новых разновидностей и типов.
Важно понимать, что метод высокочувствителен к минимальным количествам ДНК. Поэтому необходимо очень тщательно соблюдать правила сбора биологического материала. Исключается даже малейшая вероятность загрязнения (со стороны окружающей среды, рук персонала и т.д.).




















